好的,我将严格按照您的要求,忠实地保留原文的全部内容和格式,并在每个段落后添加最长、最详细的中文解释,包括对所有公式的详细解释和举例说明。解释段落将使用自增数字的连续编号标题,并正确使用美元符号包裹公式。
十二烷基硫酸钠 Sodium Dodecyl Sulfate, SDS(SDS)胶束 micelles化 micellization的热力学 Thermodynamics:一项本科生实验室实验
Juan P. Marcolongo 和 Martín Mirenda*
布宜诺斯艾利斯大学精确与自然科学学院无机、分析与物理化学 Physical Chemistry系,1428,布宜诺斯艾利斯,阿根廷
(S) 辅助信息
1. 内容解释
这个部分是文章的标题、作者信息和所属机构。
- 标题:“十二烷基硫酸钠 Sodium Dodecyl Sulfate, SDS(SDS)胶束 micelles化 micellization的热力学 Thermodynamics:一项本科生实验室实验”。这个标题明确指出了文章的核心内容:研究一种叫做十二烷基硫酸钠 Sodium Dodecyl Sulfate, SDS(SDS)的化学物质形成胶束 micelles过程的热力学 Thermodynamics性质,并且这篇文章是作为一个本科生可以动手操作的实验项目来介绍的。
- 作者:Juan P. Marcolongo 和 Martín Mirenda*。星号(*)通常表示通讯作者,即负责与期刊编辑和读者联系的主要研究人员。
- 所属机构:指明了作者进行研究工作的地点,即阿根廷布宜诺斯艾利斯大学的物理化学 Physical Chemistry相关院系。
- (S) 辅助信息:这是一个科学期刊文章中常见的标记,表示除了正文之外,还有一些额外的数据、实验细节或教学笔记等补充材料(Supporting Information)可以在线获取。这对于想要重复实验或深入了解细节的读者非常重要。
0 摘要
本文介绍了一项本科生实验室实验,该实验可对十二烷基硫酸钠 Sodium Dodecyl Sulfate, SDS(SDS)在水溶液中形成胶束 micelles进行热力学 Thermodynamics表征。通过电导法 conductometry在不同温度下测定临界胶束 micelles浓度 Critical Micelle Concentration, CMC(CMC)和胶束 micelles电离度 degree of ionization of the micelles( )。在简化的闭合缔合模型 closed association model框架内,该模型假设游离表面活性剂 surface active agent, surfactant单体 monomer与单分散 monodisperse胶束 micelles之间存在平衡 equilibrium,利用CMC、 及其温度依赖性计算胶束 micelles化 micellization过程的摩尔标准自由能 molar standard free energy( )、焓 enthalpy( )和熵 entropy( )。在此基础上,还对结果提出了基于表面活性剂 surface active agent, surfactant分子水合现象 hydration phenomena的物理化学 Physical Chemistry讨论。
2. 内容解释
摘要是对整篇论文的高度概括,让读者能快速了解研究的目的、方法、主要结果和结论。
- 研究目的:本文旨在提供一个适用于大学本科教学的实验方案,用于研究十二烷基硫酸钠 Sodium Dodecyl Sulfate, SDS(SDS)在水中形成胶束 micelles过程的热力学 Thermodynamics特性。
- 核心物质:十二烷基硫酸钠 Sodium Dodecyl Sulfate, SDS(Sodium Dodecyl Sulfate, SDS),是一种常见的阴离子 ion** anion表面活性剂 surface active agent, surfactant**,广泛用于洗涤剂、洗发水等产品中。
- 研究现象:胶束 micelles化 micellization(micellization),即表面活性剂 surface active agent, surfactant分子在溶液中浓度达到一定值后自发聚集成球状、棒状等结构的现象。
- 实验方法:电导法 conductometry(conductometry)。通过测量SDS溶液的电导率 Conductivity随浓度的变化来确定两个关键参数:
- 临界胶束 micelles浓度 Critical Micelle Concentration, CMC**(Critical Micelle Concentration, CMC):开始形成胶束 micelles**的最低浓度。
- 胶束 micelles电离度 degree of ionization of the micelles**(degree of ionization of the micelles, ):胶束 micelles表面解离出的反离子 ion counterion数与组成胶束 micelles的表面活性剂 surface active agent, surfactant离子 ion总数之比,反映了胶束 micelles**的带电程度。
- 理论模型:“闭合缔合模型 closed association model”(closed association model)。这是一个简化的理论模型,用于描述胶束 micelles形成过程。它假设溶液中只存在两种状态的表面活性剂 surface active agent, surfactant分子:自由的单个分子(单体 monomer)和大小完全相同的胶束 micelles(单分散 monodisperse胶束 micelles),并且这两者之间处于一个动态的化学平衡 equilibrium** chemical equilibrium**中。
- 计算内容:利用实验测得的CMC和 值,以及它们如何随温度变化的规律,来计算三个核心的热力学 Thermodynamics函数:
- 摩尔标准吉布斯自由能 molar standard Gibbs free energy**():判断胶束 micelles化 micellization**过程能否自发进行的判据。负值表示自发。
- 摩尔标准焓 enthalpy molar standard enthalpy**():表示胶束 micelles化 micellization**过程中的热量变化。放热为负,吸热为正。
- 摩尔标准熵 entropy molar standard entropy**():表示胶束 micelles化 micellization**过程中系统混乱度的变化。熵 entropy增为正,熵 entropy减为负。
- 结果讨论:最后,文章会对计算出的热力学 Thermodynamics结果进行物理解释,特别是从“水合现象 hydration phenomena”(hydration phenomena)的角度来讨论,即水分子如何与表面活性剂 surface active agent, surfactant分子相互作用,并在胶束 micelles形成过程中发生变化。

关键词:高年级本科生,物理化学 Physical Chemistry,实验室教学,动手学习/操作,水溶液化学 Aqueous Solution Chemistry,电导率 Conductivity,胶束 micelles,有机硫化合物 Organosulfur Compounds,热力学 Thermodynamics
3. 内容解释
这部分是文章的关键词列表,用于数据库索引和文献检索,帮助其他研究人员快速找到这篇文章。
- 高年级本科生 (Upper-Division Undergraduate):表明该实验的设计难度和深度适合大学三、四年级的学生。
- 物理化学 Physical Chemistry** (Physical Chemistry)**:指明了该实验所属的学科领域。
- 实验室教学 (Laboratory Instruction):强调了本文的教学目的,它是一个实验指导而非纯粹的基础研究。
- 动手学习/操作 (Hands-On Learning/Manipulation):再次突出了该实验的实践性。
- 水溶液化学 Aqueous Solution Chemistry*(Aqueous Solution Chemistry)**:说明研究的体系是在水中进行的化学过程。
- 电导率 Conductivity** (Conductivity)**:指出了核心的实验测量技术。
- 胶束 micelles** (Micelles)**:指出了研究的核心对象。
- 有机硫化合物 Organosulfur Compounds** (Organosulfur Compounds):从化学分类上定义了SDS,因为它含有一个硫酸根基团,属于有机硫化合物 Organosulfur Compounds**。
- 热力学 Thermodynamics** (Thermodynamics)**:指出了研究的理论框架和最终目标。
1 引言
表面活性剂 surface active agent, surfactant(surface active agent)是两亲性 amphiphilic化合物,包含一个疏水“尾部” hydrophobic tail和一个极性(离子 ion或非离子 ion)“头部”。它们广泛存在于日常生活中使用的众多商业产品中,如洗涤剂、洗发水和油。尽管胶束 micelles态日益重要,但在大多数普通或实验物理化学 Physical Chemistry教科书中通常被忽视。由于这些系统对化学家来说具有明显的专业相关性,因此将其研究纳入本科教育课程是一个重要领域。
4. 内容解释
引言的第一段旨在介绍研究背景和动机。
- 定义表面活性剂 surface active agent, surfactant:首先清晰地定义了什么是表面活性剂 surface active agent, surfactant。它是一种“两亲性 amphiphilic”(amphiphilic)分子,意味着它同时具有“亲水”和“疏水”两个部分。
- 疏水“尾部” hydrophobic tail** (hydrophobic "tail")**:通常是一条长长的碳氢链(如SDS中的十二烷基链),它不溶于水,倾向于避开水。
- 极性“头部” (polar "head"):通常是一个离子 ion基团或强极性基团(如SDS中的硫酸根),它易溶于水,倾向于与水分子接触。
- 实际应用:强调了表面活性剂 surface active agent, surfactant的重要性,列举了它们在日常生活中的应用,如洗涤剂和洗发水,这使得研究它们具有很强的现实意义。
- 教育现状:指出了一个问题,即尽管表面活性剂 surface active agent, surfactant和胶束 micelles在工业和生活中非常重要,但在标准的物理化学 Physical Chemistry教科书中却往往被忽略。
- 研究动机:基于上述问题,作者认为将表面活性剂 surface active agent, surfactant和胶束 micelles的研究引入本科化学实验课程是非常有必要的,可以弥补课程设置上的不足,并增强学生所学知识与实际应用的联系。
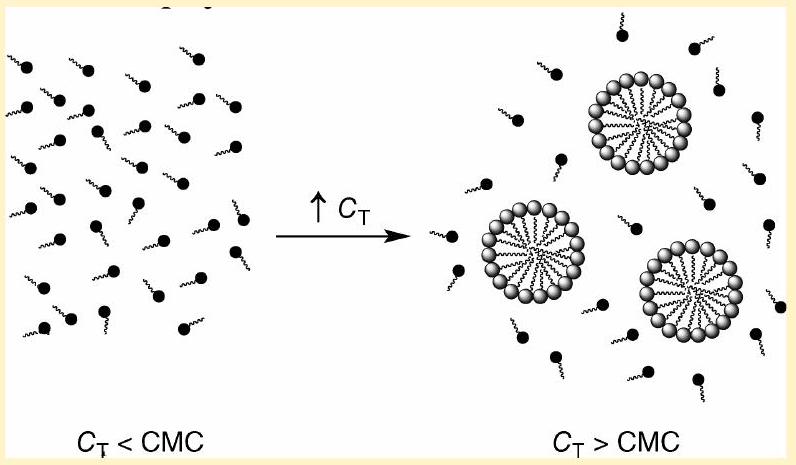
众所周知,当表面活性剂 surface active agent, surfactant浓度超过一个临界值(通常称为临界胶束 micelles浓度 Critical Micelle Concentration, CMC,CMC)时,溶液中的表面活性剂 surface active agent, surfactant分子会自发地排列成自组织 self-organized的胶束 micelles结构。本刊已提出多项实验,旨在让本科生熟悉胶束 micelles系统¹˒² 以及测定CMC值的实验技术³⁻⁷。然而,这些文章并未在本科水平上处理这些系统的热力学 Thermodynamics解释。
5. 内容解释
这一段进一步聚焦于研究的具体问题,并回顾了相关领域的已有工作(文献综述)。
- 核心概念介绍:引入了两个关键概念:
- 临界胶束 micelles浓度 Critical Micelle Concentration, CMC** (Critical Micelle Concentration, CMC):这是一个阈值浓度。当溶液中表面活性剂 surface active agent, surfactant的浓度低于CMC时,它们主要以单个分子的形式存在;当浓度超过CMC时,它们开始自发地聚集形成胶束 micelles**。
- 胶束 micelles** (micelle):这是一种自组装结构。在水溶液中,表面活性剂 surface active agent, surfactant的疏水尾部 hydrophobic tail**会聚集在一起,形成一个油性的核心,以避开水;而亲水的头部则朝向外部,与水接触,形成一个稳定的聚集体。
- 文献回顾:作者提到了在本期刊(Journal of Chemical Education)上已经发表过一些关于胶束 micelles的本科生实验。这些实验主要集中在两个方面:
- 让学生了解胶束 micelles系统本身。
- 教授学生如何用不同的实验技术(如荧光法、表面张力法等)来测量CMC值。
- 研究缺口:作者指出了现有文献的不足之处,即之前的实验虽然测量了CMC,但很少深入到对胶束 micelles形成过程进行完整的热力学 Thermodynamics解释。换句话说,它们没有系统地教学生如何从实验数据计算出吉布斯自由能、焓 enthalpy和熵 entropy,并理解这些热力学 Thermodynamics参数背后的物理意义。这正是本文要填补的空白。
在宽浓度范围内进行的离子 ion表面活性剂 surface active agent, surfactant溶液的电导率 Conductivity测量可用于确定CMC和胶束 micelles电离度 degree of ionization of the micelles 。该方法依赖于溶液中游离表面活性剂 surface active agent, surfactant分子的电导率 Conductivity与胶束 micelles排列中分子相关联时的电导率 Conductivity之间的差异。尽管其应用广泛,但文献中存在不同的方法来描述观察到的电导率 Conductivity数据。一些作者认为构成胶束 micelles的表面活性剂 surface active agent, surfactant单体 monomer的电导率 Conductivity应与溶液中游离单体 monomer的电导率 Conductivity相同⁸⁻¹⁰,而另一些作者则认为该电导率 Conductivity应更方便地以斯托克斯定律 Stokes' law表示¹¹。然而,通过这两种方法获得的CMC是相同的,而 则有明显的差异。
6. 内容解释
这一段详细介绍了本研究选用的实验方法——电导法 conductometry,并指出了该方法在理论处理上存在的一些争议。
- 电导法 conductometry的原理:测量离子 ion表面活性剂 surface active agent, surfactant溶液的电导率 Conductivity可以得到CMC和胶束 micelles电离度 degree of ionization of the micelles 。其基本原理是:
- 在CMC以下,增加表面活性剂 surface active agent, surfactant浓度,溶液中自由移动的离子 ion(表面活性剂 surface active agent, surfactant阴离子 ion** anion和其反离子 ion counterion**,如SDS中的 S⁻ 和 Na⁺)数量成比例增加,电导率 Conductivity线性上升。
- 在CMC以上,新加入的表面活性剂 surface active agent, surfactant分子主要形成胶束 micelles。胶束 micelles是一个体积庞大、带有部分电荷的聚集体,其移动速度远低于单个小离子 ion,并且它会束缚一部分反离子 ion** counterion**,导致溶液中有效载流子的增加速率变慢。因此,电导率 Conductivity随浓度增加的斜率 slope会突然变小。这个斜率 slope变化的转折点就是CMC。
- 理论处理上的分歧:作者指出了在分析CMC以上电导率 Conductivity数据时,文献中存在的两种不同处理方法。争议的核心在于如何估算胶束 micelles本身的电导率 Conductivity(即胶束 micelles作为一个带电粒子对总电导率 Conductivity的贡献)。
- 方法一:假设组成胶束 micelles的表面活性剂 surface active agent, surfactant单体 monomer在导电性上的贡献与自由单体 monomer相同。
- 方法二:使用斯托克斯定律 Stokes' law(Stokes' law)来估算胶束 micelles的电导率 Conductivity。斯托克斯定律 Stokes' law描述了球形物体在流体中的运动,可以关联离子 ion的尺寸、电荷和其电导能力。
- 不同方法的影响:作者强调,无论使用哪种方法,最终确定的CMC值是相同的,因为CMC是由电导率 Conductivity-浓度曲线的转折点决定的,这个点的位置不受后续斜率 slope具体模型的太大影响。但是,计算出的胶束 micelles电离度 degree of ionization of the micelles** 的值会有显著差异**,因为 的计算直接依赖于CMC以上那段曲线的斜率 slope,而不同的理论模型会给出不同的斜率 slope表达式。
在不同温度下获得的CMC值可用于胶束 micelles形成的热力学 Thermodynamics表征。这需要以显式形式评估CMC的温度依赖性,这可以通过使用不同代数表达式拟合实验数据来获得。Kim和Lim¹⁶建议使用 形式的函数,而非广泛使用的二阶¹²˒¹⁴˒¹⁵ 和三阶多项式表达式⁹,理由是前者没有理论基础。通常,与胶束 micelles系统相关的热力学 Thermodynamics量计算不考虑 对温度的依赖性¹⁰˒¹⁷,这导致相关热力学 Thermodynamics信息存在不可忽略的差异¹⁸。
7. 内容解释
本段讨论了从实验数据到热力学 Thermodynamics参数计算过程中的关键步骤和潜在问题,即如何处理数据和选择合适的数学模型。
- 热力学 Thermodynamics表征的基础:要计算胶束 micelles化 micellization的热力学 Thermodynamics参数(如焓 enthalpy和熵 entropy),核心是需要知道CMC如何随温度变化。通过在多个不同温度下测量CMC值,可以得到一系列 (T, CMC) 数据点。
- 数据处理方法:为了从离散的数据点得到一个连续的函数关系,需要对这些数据进行拟合。文献中使用了不同的数学函数来拟合 CMC vs. T 的关系:
-
常用方法:使用简单的多项式,如二阶(抛物线)或三阶多项式来拟合。
-
推荐方法:Kim和Lim¹⁶ 建议使用一个更有物理背景的函数形式:
其中 , , 是拟合常数, 是绝对温度。这种形式虽然更复杂,但被认为可能比纯粹数学上的多项式拟合更合理。
-
- 另一个常见问题:作者指出了一个在文献中常见的简化处理,即在计算热力学 Thermodynamics量时忽略了胶束 micelles电离度 degree of ionization of the micelles** 随温度的变化**,假设它是一个常数。
- 该问题的影响:作者引用文献¹⁸指出,这种忽略 依赖性的做法会导致计算出的热力学 Thermodynamics信息(特别是焓 enthalpy和熵 entropy)出现不可忽略的误差。因此,一个更精确的处理方法应该同时考虑CMC和 随温度的变化。
由于胶束 micelles系统文献中存在多种方法,以及需要在本科课程中引入新的实验室实验,本文提出了一项简单、可靠且经济的实验,用于提取离子 ion表面活性剂 surface active agent, surfactant在水溶液中胶束 micelles化 micellization过程相关的热力学 Thermodynamics信息。当前的实验室实验基于在不同温度下通过测量电导率 Conductivity来确定十二烷基硫酸钠 Sodium Dodecyl Sulfate, SDS(SDS)的CMC。使用简单的“闭合缔合模型 closed association model”,该实验涉及胶束 micelles化 micellization热力学 Thermodynamics参数的计算及其基于表面活性剂 surface active agent, surfactant分子水合现象 hydration phenomena等概念的物理解释。
8. 内容解释
这是引言的最后一段,总结了本文的目的和贡献。
- 动机总结:基于前文提到的两个问题——(1)文献中处理数据的方法不统一;(2)本科教学中缺乏此类综合性实验——作者提出了他们的解决方案。
- 本文贡献:提出一个简单、可靠且经济的本科实验方案。
- 简单:操作不复杂,使用常规的电导率 Conductivity仪 conductivity meter即可。
- 可靠:实验结果重现性好。
- 经济:所用试剂和仪器成本较低。
- 实验核心内容:
- 在不同温度下,用电导法 conductometry测量SDS的CMC。
- 应用**“闭合缔合模型 closed association model”**作为理论框架。
- 计算全套的热力学 Thermodynamics参数(, , )。
- 对结果进行深入的物理解释,特别是关联到水合现象 hydration phenomena。 这一段清晰地勾勒出了整篇文章的结构和主要内容,为读者提供了阅读路线图。
2 闭合缔合模型 closed association model
采用闭合缔合模型 closed association model来分析实验数据。该模型假设溶液中游离表面活性剂 surface active agent, surfactant分子与单分散 monodisperse胶束 micelles处于化学平衡 equilibrium** chemical equilibrium状态,每个温度下胶束 micelles均由固定数量 的表面活性剂 surface active agent, surfactant分子组成。通常,胶束 micelles溶液并非单分散 monodisperse¹⁹˒²⁰;然而,文献中已表明²¹˒²²,这种偏差不会显著影响模型的有效性。为了描述SDS表面活性剂 surface active agent, surfactant在无盐水溶液中的胶束 micelles化 micellization过程,提出了以下平衡 equilibrium**:
其中 和 分别代表十二烷基硫酸根阴离子 ion** anion和钠阳离子 ion cation**,胶束 micelles 是带净电荷 的部分,包含 个SDS分子和 个钠离子 ion。相应的单体 monomer-胶束 micelles平衡 equilibrium常数 equilibrium constant 可表示为
其中方括号表示摩尔浓度 molar concentration。通常,CMC足够低,因此离子 ion活度系数 activity coefficient可以安全地近似为1。
9. 内容解释
这一部分详细介绍了用于分析实验数据的核心理论模型——闭合缔合模型 closed association model。
-
模型的核心假设:
- 二态模型:溶液中只存在两种组分:自由的表面活性剂 surface active agent, surfactant单体 monomer和胶束 micelles。不存在中间大小的聚集体。
- 化学平衡 equilibrium chemical equilibrium:单体 monomer和胶束 micelles之间存在一个动态的化学平衡 equilibrium** chemical equilibrium**。
- 单分散 monodisperse性:在特定温度下,所有胶束 micelles的大小都完全相同,都由 个表面活性剂 surface active agent, surfactant分子构成。 被称为聚集数 aggregation number** (aggregation number)**。
-
模型的局限性与合理性:作者承认,真实的胶束 micelles溶液通常是多分散 polydisperse的,即胶束 micelles的大小存在一个分布范围,而不是单一尺寸。但作者也引用文献指出,对于热力学 Thermodynamics分析,这种简化(单分散 monodisperse假设)所带来的误差不大,不影响模型的有效性。
-
胶束 micelles化 micellization平衡 equilibrium反应式:
这个化学方程式是模型的核心,描述了胶束 micelles的形成过程。* 反应物:
- : 个十二烷基硫酸根阴离子 ion** anion**(),它们是表面活性剂 surface active agent, surfactant的主体。
- : 个钠离子 ion(),它们是反离子 ion** counterion**。
- 生成物:
- :一个胶束 micelles。这个胶束 micelles由 个 阴离子 ion** anion构成,但同时它也紧密地“束缚”了 个 阳离子 ion cation**在它的表面(称为Stern层),以部分中和其负电荷。
- 净电荷:由于有 个负电荷和 个正电荷,胶束 micelles的净电荷是 。所以 代表胶束 micelles表面的有效电荷数。
- :该平衡 equilibrium反应的平衡 equilibrium常数 equilibrium constant。
-
平衡 equilibrium常数 equilibrium constant表达式 (公式 1):
这是根据质量作用定律写出的平衡 equilibrium常数 equilibrium constant表达式。* 分子:生成物(胶束 micelles)的摩尔浓度 molar concentration 。
- 分母:反应物浓度的乘积,每种物质的浓度都取其化学计量系数作为幂。即自由 浓度的 次方和自由 浓度的 次方。
- 方括号 []:表示摩尔浓度 molar concentration(mol/L)。
-
活度系数 activity coefficient近似:作者提到,因为CMC通常很低(稀溶液),溶液中离子 ion的相互作用可以忽略不计,因此可以用浓度代替活度(即活度系数 activity coefficient )。这是一个常见的简化,使得计算更加方便。
3 热力学 Thermodynamics计算
胶束 micelles形成的标准自由能 可以用 表示:
结合方程1和2并除以 ,我们得到
其中 是胶束 micelles电离度 degree of ionization of the micelles。考虑到SDS胶束 micelles通常包含大量表面活性剂 surface active agent, surfactant分子( ),方程3右侧的第一项相对于其他两项可以忽略不计。此外,当表面活性剂 surface active agent, surfactant浓度接近CMC时, 。在这种情况下,方程3可以重写为
10. 内容解释
这一部分推导了计算胶束 micelles化 micellization过程热力学 Thermodynamics参数的核心公式,起点是标准的热力学 Thermodynamics关系和闭合缔合模型 closed association model。
-
公式 (2):吉布斯自由能与平衡 equilibrium常数 equilibrium constant的关系
这是一个基础热力学 Thermodynamics公式,它将宏观的热力学 Thermodynamics量(标准吉布斯自由能变 )与微观的平衡 equilibrium常数 equilibrium constant 联系起来。
- :每摩尔表面活性剂 surface active agent, surfactant单体 monomer在形成胶束 micelles过程中的标准吉布斯自由能变。上划线 通常表示摩尔量。
- :理想气体常数 ideal gas constant (8.314 J·K⁻¹·mol⁻¹)。
- :绝对温度 (单位:开尔文, K)。
- :胶束 micelles化 micellization平衡 equilibrium常数 equilibrium constant的自然对数。 这个公式的物理意义是,平衡 equilibrium常数 equilibrium constant越大(反应越倾向于生成物), 越大, 就越负,表明反应的自发性越强。
-
公式 (3):展开表达式 将公式(1)代入公式(2),然后利用对数的性质( 和 )进行展开,最后将总的自由能变 除以聚集数 aggregation number ,得到每个单体 monomer的平均自由能变 。
这里引入了胶束 micelles电离度 degree of ionization of the micelles** ** 的定义:
它表示胶束 micelles的净电荷数 与组成胶束 micelles的单体 monomer总数 的比值。因此, 。
-
简化与近似:为了得到一个更实用、能直接与实验数据联系的公式,作者做了两个关键的近似:
- 忽略胶束 micelles浓度项:公式(3)右边的第一项 。因为 是一个大数(对于SDS通常是50-70),所以 很小。这使得第一项远小于后面两项,可以忽略。
- 在CMC处进行计算:CMC是胶束 micelles开始大量形成的临界点,可以近似看作是单体 monomer-胶束 micelles平衡 equilibrium发生的特征浓度。在该点,自由表面活性剂 surface active agent, surfactant阴离子 ion** anion的浓度 和反离子 ion counterion**浓度 都约等于CMC值。
- (因为没有额外添加盐,溶液中钠离子 ion全部来自于SDS的解离)。
-
公式 (4):最终的实用公式 将上述两个近似代入公式(3),可以得到最终的简化表达式:
这个公式非常重要,因为它直接将热力学 Thermodynamics量 与两个可以通过实验测定的物理量——CMC 和 ——联系了起来。这样,只要在特定温度 下测出 CMC 和 ,就可以计算出该温度下的标准吉布斯自由能变。
上述表达式可以插入经典的吉布斯-赫姆霍兹方程 Gibbs-Helmholtz equation
得到胶束 micelles形成的摩尔标准焓 enthalpy** molar standard enthalpy** 的以下表达式,
最后,胶束 micelles形成的摩尔标准熵 entropy** molar standard entropy** 可以使用以下公式计算
11. 内容解释
这部分接着推导了另外两个重要的热力学 Thermodynamics参数:焓 enthalpy变()和熵 entropy变()。
-
吉布斯-赫姆霍兹方程 Gibbs-Helmholtz equation
这是一个基本的热力学 Thermodynamics关系式,它描述了吉布斯自由能 如何随温度 变化,并将其与焓 enthalpy变 联系起来。这里的 表示对温度求偏导数。通过这个方程,如果我们知道了 的函数形式,就可以通过求导来得到 。
-
公式 (5):计算摩尔标准焓 enthalpy molar standard enthalpy** ** 推导过程如下:
- 将公式(4) 两边同除以 ,得到 。
- 对上式两边关于温度 求偏导。注意,这里的 和 都是温度的函数,所以需要使用乘法求导法则 。
- 将求导结果代入吉布斯-赫姆霍兹方程 Gibbs-Helmholtz equation,并整理,即可得到公式(5):
这个公式的物理意义是,胶束 micelles化 micellization的焓 enthalpy变(热效应)取决于两个因素:
- :CMC随温度的变化率。这可以通过对实验数据拟合出的 vs. 曲线求导数得到。
- :胶束 micelles电离度 degree of ionization of the micelles随温度的变化率。这同样需要通过实验测量不同温度下的 值并进行拟合求导得到。 这个公式也凸显了为什么作者在引言中强调考虑 的温度依赖性是重要的。如果忽略第二项,计算出的 将会不准确。
-
公式 (6):计算摩尔标准熵 entropy molar standard entropy** **
这是吉布斯自由能的定义式。一旦我们通过公式(4)计算出了 ,并通过公式(5)计算出了 ,就可以通过简单地重新排列这个方程来求得摩尔标准熵 entropy** molar standard entropy**变 :
至此,通过测量不同温度下的CMC和 ,我们已经建立了一套完整的方法来计算胶束 micelles化 micellization过程的三个基本热力学 Thermodynamics参数。
4 通过电导率 Conductivity测量确定CMC和
胶束 micelles形成的热力学 Thermodynamics计算所需的CMC和 值可以通过电导法 conductometry获得。Bachofer previously在《本刊》中报道了离子 ion表面活性剂 surface active agent, surfactant的电导率 Conductivity测量⁴。描述离子 ion表面活性剂 surface active agent, surfactant溶液在CMC以下或以上的电导率 Conductivity的数学表达式是不同的。在CMC以下,SDS分子被认为是完全解离的1:1强电解质 strong electrolyte。在这种情况下,假设离子 ion摩尔电导率 Conductivity** ionic molar conductivity与浓度无关,表面活性剂 surface active agent, surfactant溶液的电导率 Conductivity** 可以计算为
其中 和 分别是十二烷基硫酸根阴离子 ion** anion和 的离子 ion摩尔电导率 Conductivity ionic molar conductivity**(以 mS M cm 表示), 是总摩尔表面活性剂 surface active agent, surfactant浓度, 代表在CMC以下 对 作线性拟合的斜率 slope。
12. 内容解释
这一部分开始详细阐述如何通过电导率 Conductivity实验数据来具体确定CMC和 这两个关键参数。本段首先描述CMC以下区域的情况。
-
电导法 conductometry的基本思路:通过测量溶液电导率 Conductivity 随总表面活性剂 surface active agent, surfactant浓度 的变化,绘制 - 曲线。这条曲线在CMC点会有一个明显的转折(斜率 slope变化),通过分析转折前后的直线斜率 slope,就可以提取出所需信息。
-
CMC以下的情况:
- 物理图像:当浓度低于CMC时,溶液中没有胶束 micelles。SDS分子被认为是完全解离的 1:1强电解质 strong electrolyte,就像NaCl一样,在水中完全解离成 阴离子 ion** anion和 阳离子 ion cation**。
- 电导率 Conductivity模型:溶液的总电导率 Conductivity 是所有离子 ion贡献的总和。根据科尔劳施离子 ion独立运动定律,总电导率 Conductivity约等于各离子 ion的摩尔电导率 Conductivity 与其浓度的乘积之和。
-
公式 (7):CMC以下的电导率 Conductivity
-
:溶液的电导率 Conductivity(单位:S/cm 或 mS/cm)。
-
:十二烷基硫酸根阴离子 ion** anion的摩尔电导率 Conductivity**。
-
:钠离子 ion的摩尔电导率 Conductivity。
-
:SDS的总摩尔浓度 molar concentration。因为是1:1电解质,所以 。
-
线性关系:这个公式表明,在CMC以下, 与 成正比。
-
:定义为 - 图在CMC以下区域的斜率 slope。
这个斜率 slope 可以通过对实验数据点进行线性拟合得到,它代表了自由的SDS单体 monomer(阴离子 ion** anion**+阳离子 ion** cation**)对电导率 Conductivity的贡献。
-
在CMC以上,游离SDS分子与胶束 micelles结构共存,胶束 micelles结构被认为是弱电解质 weak electrolyte。SDS浓度的增加导致胶束 micelles浓度的增加,而游离表面活性剂 surface active agent, surfactant浓度在CMC值附近实际上保持不变。在这种情况下,SDS溶液的电导率 Conductivity可以表示为
其中 是胶束 micelles的离子 ion电导率 Conductivity, 是胶束 micelles的摩尔浓度 molar concentration。原则上, 的值是未知的,但可以使用两种不同的方法进行估计:(i)认为 ,或(ii)采用斯托克斯定律 Stokes' law,该定律规定球形离子 ion的电导率 Conductivity与电荷的平方除以离子 ion半径成正比。使用后一种方法,获得的热力学 Thermodynamics量与文献报道的 值吻合良好。
13. 内容解释
本段描述了CMC以上区域的电导率 Conductivity模型,这是分析中更复杂的部分。
-
CMC以上的物理图像:
- 溶液中同时存在三种导电物质:自由的 阴离子 ion** anion**、自由的 阳离子 ion** cation**,以及带电的胶束 micelles 。
- 一个关键假设是,一旦浓度超过CMC,自由单体 monomer的浓度就基本保持在CMC值不再增加。所有新加入的SDS都用于形成胶束 micelles。
- 胶束 micelles本身可以看作是一个“弱电解质 weak electrolyte”,因为它部分解离,释放出 个反离子 ion** counterion**,同时自身带净电荷 。
-
公式 (8):CMC以上的电导率 Conductivity
这个公式将总电导率 Conductivity 分解为三个部分的贡献之和:
- 第一项: 这代表了浓度保持在CMC水平的自由单体 monomer和它们对应的反离子 ion counterion的贡献。这部分可以看作是一个恒定的背景电导率 Conductivity。
- 第二项:
这代表了胶束 micelles本身的贡献。
- :浓度超过CMC的部分,即全部形成胶束 micelles的SDS的浓度。
- :胶束 micelles的摩尔浓度 molar concentration(因为每个胶束 micelles由 个单体 monomer构成)。
- :每个胶束 micelles的摩尔电导率 Conductivity。
- 第三项:
这代表了与新形成的胶束 micelles相关的额外自由反离子 ion counterion的贡献。
- :形成胶束 micelles的SDS单体 monomer的总浓度。
- :从这些胶束 micelles上解离下来的自由反离子 ion** counterion**()的总浓度。因为每个单体 monomer进入胶束 micelles后,平均会释放 个反离子 ion** counterion**。
- :自由 的摩尔电导率 Conductivity。
-
未知数 的处理: 公式(8)中有一个未知参数 (胶束 micelles的摩尔电导率 Conductivity)。作者提到了两种估算它的方法,并选择了第二种:
- 方法 (i):假设胶束 micelles的电导率 Conductivity等于其内部所有解离的表面活性剂 surface active agent, surfactant离子 ion的电导率 Conductivity之和,即 。
- 方法 (ii):采用斯托克斯定律 Stokes' law。该定律认为,离子 ion的电导率 Conductivity与其(有效电荷)² 成正比,与其(水合)半径成反比。作者指出,使用这种方法得到的热力学 Thermodynamics结果与文献值吻合得更好,因此本文采用此方法。
假设胶束 micelles半径与 成比例¹¹, 可以近似为
在斯托克斯定律 Stokes' law近似的范畴内, 的值可以从 估计,即单电荷( )SDS单体 monomer( )的电导率 Conductivity。方程8可以重新排列得到
将方程7和9代入方程10并重新排列,得到以下表达式
方程11的左侧表示CMC以上 对 作线性拟合的斜率 slope 。考虑到 的定义,此方程可以改写为二次方程
14. 内容解释
这一部分是本文在数学推导上的核心,展示了如何从电导率 Conductivity数据中求解出胶束 micelles电离度 degree of ionization of the micelles 。
-
公式 (9):基于斯托克斯定律 Stokes' law的 模型
这个公式是对斯托克斯定律 Stokes' law的具体应用。
- 电荷:胶束 micelles的有效电荷为 ,所以电导率 Conductivity正比于 。
- 半径:假设胶束 micelles是球形的,其体积正比于聚集数 aggregation number 。球的体积 ,所以半径 正比于 ,即 。电导率 Conductivity与半径成反比,所以与 成反比。
- 比例常数: 被用作一个参考值或比例常数,它代表了一个单体 monomer()的情况。
-
公式 (10):重排公式(8) 对公式(8)进行代数变形,目的是为了分离出CMC以上区域的斜率 slope。将第一项移到左边,然后两边同除以 ,就得到了公式(10)。
公式(10)的左边正是 对 在CMC以上作图的斜率 slope,我们称之为 。所以:
-
公式 (11):代入与替换 现在将公式(9)代入到 的表达式中,并利用之前定义的 (即 ),进行替换:
这就是公式(11)。
-
公式 (12):求解 的二次方程 我们最终的目标是求 。在公式(11)中,我们用 (即 ) 来替换 :
将上式整理成一个关于 的标准二次方程 的形式,就得到了公式(12):
这个方程是求解 的关键。在这个方程中:
- 和 是我们可以从实验的 - 图中直接测量得到的两个斜率 slope。
- (聚集数 aggregation number) 和 (钠离子 ion摩尔电导率 Conductivity** ionic molar conductivity**) 需要从文献中查找对应温度下的值。
- 是唯一的未知数。 通过求解这个二次方程,就可以得到胶束 micelles电离度 degree of ionization of the micelles 的值。
为了从方程12中评估 ,需要额外的假设:
(i)首先,允许 随温度变化。Zana及其同事¹³报告的实验数据通过内插和外推法获得了 值: ( )、 ( )、 ( )、 ( )、 ( )、 ( )、 ( )、 ( )和 ( )(见辅助信息中包含的学生书面说明)。
(ii)其次, 的值近似为无限稀释 infinite dilution溶液中的值 。Benson和Gordon²³报告的实验数据通过线性插值法计算了 值: ( )、 ( )、 ( )、 ( )、 ( )、 ( )、 ( )、 ( )和 ( )(见辅助信息中包含的学生书面说明)。
15. 内容解释
这一段提供了求解公式(12)所需的两个关键参数 和 的具体数据来源和处理方法,是理论联系实际的重要一步。
- 求解方程(12)的前提:为了解出 ,我们需要知道方程中其他所有参数的值。其中 和 来自本次实验,而 和 则需要借助外部数据。
- 假设 (i):聚集数 aggregation number 随温度变化:
- 作者明确指出,胶束 micelles的聚集数 aggregation number 不是一个常数,它会随着温度的改变而变化。通常情况下,对于SDS这类表面活性剂 surface active agent, surfactant,温度升高, 会减小。
- 数据来源:作者引用了Zana等人的研究工作¹³,他们通过实验测量了不同温度下SDS胶束 micelles的聚集数 aggregation number。
- 具体数值:这里列出了一系列在不同温度下的 值,例如在284 K(约11°C)时 ,而在333 K(约60°C)时减小到 。对于实验中未直接列出的温度点,可以通过插值法(在两个已知点之间估算)或外推法(在已知点范围之外估算)来获得。
- 假设 (ii):钠离子 ion摩尔电导率 Conductivity ionic molar conductivity** 的取值**:
- 近似处理:理论上,离子 ion的摩尔电导率 Conductivity会随溶液浓度变化而略有变化。这里做了一个合理的简化:使用无限稀释 infinite dilution时的摩尔电导率 Conductivity 来近似实际溶液中的 。因为实验溶液浓度总体较低,这个近似是可接受的。
- 数据来源:作者引用了Benson和Gordon的研究²³,他们精确测量了 在不同温度下的值。
- 具体数值:同样,这里列出了一系列在不同温度下的 值(单位应为 mS·M⁻¹·cm² 或类似单位,原文中单位可能简写),例如在298 K(25°C)时为50.6。同样,对于其他温度点,可以通过线性插值来计算。
总结:这一段的实际操作意义是,学生在做这个实验时,测量完自己数据的 和 后,需要查阅辅助材料或本文给出的数据表,根据自己的实验温度,通过插值找到对应的 和 值,然后代入公式(12),解一个一元二次方程,最终得到该温度下的胶束 micelles电离度 degree of ionization of the micelles 。
5 材料与方法
电泳级SDS由Sigma提供并直接使用。溶液用去离子 ion水(10 MΩ cm)配制,该水先前已在配备0.22 μm孔径滤器的商用Millipore Milli-Q系统(MQ水)中过滤。为了进行电导率 Conductivity测量,配制了五种浓度低于0.20% w/v(0.01、0.05、0.09、0.12和0.18% w/v)和五种浓度高于0.30% w/v(0.30、0.40、0.50、0.60和0.70% w/v)的SDS溶液。
将装有不同浓度SDS溶液的玻璃瓶放入配有Julabo EM恒温器的恒温水槽中。温度调节精度为0.2°C。为了测定溶液的电导率 Conductivity,使用了型号为162 A的数字台式电导率 Conductivity仪 conductivity meter。该数字电导率 Conductivity仪 conductivity meter先前已用两种氯化钠标准溶液进行校准 calibration:692 ppm(1413 μS cm⁻¹)和7230 ppm(12.9 mS cm⁻¹),以确定电池常数 cell constant。
16. 内容解释
这部分详细描述了实验的具体操作流程、所用试剂和仪器,是科学论文中确保实验可重复性的关键部分。
- 试剂与溶剂:
- SDS:使用了“电泳级”(electrophoresis grade)的SDS,这是一种高纯度等级,确保没有杂质影响电导率 Conductivity测量。供应商是Sigma公司。试剂是“直接使用”,意味着没有进行额外的纯化步骤。
- 水:使用了高质量的去离子 ion水,电阻率高达 10 MΩ·cm,表明水中离子 ion含量极低。水还经过了0.22 μm的滤膜过滤,以去除微小颗粒和微生物。这种水通常被称为Milli-Q水或超纯水。
- 溶液配制:
- 为了准确地确定CMC这个转折点,实验设计者在预计的CMC(约0.23% w/v)两侧都配制了一系列浓度的溶液。
- CMC以下:配制了5个浓度点,从0.01%到0.18% w/v。
- CMC以上:配制了5个浓度点,从0.30%到0.70% w/v。
- 浓度单位:% w/v 表示质量/体积百分浓度,即每100毫升溶液中溶质的克数。
- 实验条件控制与测量:
- 温度控制:将装有样品的玻璃瓶放入恒温水槽中,使用Julabo EM恒温器精确控制温度,精度为 ±0.2°C。这是进行热力学 Thermodynamics研究的基础,因为所有参数都依赖于温度。
- 电导率 Conductivity测量:使用一台数字台式电导率 Conductivity仪 conductivity meter进行测量。
- 仪器校准 calibration:在测量之前,用两种已知电导率 Conductivity的氯化钠(NaCl)标准溶液对电导率 Conductivity仪 conductivity meter进行了校准 calibration。校准 calibration的目的是为了精确测定电导池的“电极常数 cell constant”(cell constant),这是将仪器读数(电阻或电导)准确转换为标准电导率 Conductivity值(如 μS/cm)所必需的步骤。
6 危险性
制备SDS固体制剂溶液时必须特别小心,因为它可能引起呼吸道和皮肤过敏反应。本实验没有其他重大危险。
17. 内容解释
这一部分是关于实验安全性的说明,是任何实验指导中必不可少的内容。
- 主要危险源:固体的SDS粉末。
- 具体危害:
- 呼吸道刺激:SDS粉末非常细小轻盈,容易被吸入,可能刺激呼吸道,引起不适或过敏反应。因此,在称量和溶解固体SDS时,应在通风橱中操作,并佩戴口罩。
- 皮肤刺激:SDS是一种强力的去污剂,直接接触皮肤(尤其是高浓度或长时间接触)会去除皮肤表面的油脂,导致干燥、刺激或过敏。操作时应佩戴手套。
- 总体风险评估:除了处理固体SDS时需要注意外,整个实验(主要涉及稀溶液)没有其他重大的化学或物理危险。
7 结果
对SDS溶液在不同温度下进行了电导率 Conductivity测量。在标准实验室实验中获得的结果如图1所示。对于每个温度,随着SDS浓度的变化,观察到电导率 Conductivity的拐点。这些结果与Goddard和Benson观察到的结果高度一致¹⁷。
对每个温度下拐点前后的电导率 Conductivity数据进行了线性回归 linear regression分析。在所有情况下,线性拟合都是准确的,并且在所使用的浓度范围内未观察到显著的非线性偏差。CMC值通过“Williams方法”在每个温度下确定,该方法包括求解相应的线性方程组。另外,也可以采用“Phillips方法”,该方法通过一个倒高斯函数近似电导率 Conductivity-浓度曲线的二阶导数。在该方法中,CMC将与倒高斯函数的最小值重合。然而,Mosquera及其同事²⁴已表明,对于SDS,Phillips方法与Williams方法得到的结果相同。表1中所示的结果对应于Williams方法。
18. 内容解释
这部分开始呈现实验的原始数据和初步分析结果。
- 原始数据展示:
- 实验的核心数据是不同温度下,电导率 Conductivity随SDS浓度的变化。这些数据被绘制在图1中。
- 关键现象:如图1所示,在每个温度下,电导率 Conductivity曲线都呈现出两条斜率 slope不同的直线段,中间有一个明显的拐点(break point)。这个拐点就是临界胶束 micelles浓度 Critical Micelle Concentration, CMC**(CMC)**。
- 结果验证:作者提到他们的实验结果与早期Goddard和Benson的经典研究¹⁷高度一致,这证明了本实验方法的可靠性。
- 数据处理与CMC的确定:
- 线性回归 linear regression:对每个温度下的数据,将拐点前和拐点后的数据点分别进行线性回归 linear regression(linear regression),得到两条最佳拟合直线。作者提到拟合效果很好(线性度高)。
- Williams方法:这是确定CMC的经典方法。既然我们有两条直线的方程( 和 ),那么这两条直线的交点的横坐标就是CMC。求解这个由两个线性方程组成的方程组,即可得到交点,从而确定CMC。
- Phillips方法(作为对比):作者还提到了另一种更复杂的数学方法——Phillips方法。该方法将整个曲线的转折区域看作一个平滑过渡,并通过数学手段找到“最大变化率”的点,这通常对应于曲线二阶导数的极值。
- 方法的一致性:作者引用文献²⁴指出,对于SDS这个体系,这两种方法得到的结果是相同的。因此,他们采用了更简单直观的Williams方法(求交点)。
- 结果呈现:通过这种方法计算出的CMC值被列在了表1中。
CMC在25°C下的值为8.2 mM,与使用相同技术获得的文献值⁵˒¹⁷˒²⁵吻合良好。不确定度 是通过对同一组样品进行五次独立测量取平均值计算得出的,与先前报道的值⁴相当。图2显示了 随温度的变化,在20至25°C之间观察到一个最小值。对于SDS,不同作者通过电导法 conductometry¹⁷、声学法²⁶和紫外-可见光谱法²⁷均报道了类似最小值的存在。图2显示了采用Kim和Lim¹⁶推荐的 形式的拟合结果。在进行拟合时应特别注意使用绝对温度标度。通过设定 、 和 ,获得了 的拟合。因此,上述方程适用于计算 。
19. 内容解释
这一段聚焦于CMC值及其随温度变化的趋势,这是进行热力学 Thermodynamics计算的关键一步。
- CMC值的验证:
- 作者报告了在标准温度25°C(298 K)下测得的CMC值为 8.2 mM(毫摩尔/升)。
- 他们将这个值与多个文献报道的值进行了比较,发现吻合得很好,这再次证明了实验的准确性。
- 不确定度:通过5次重复测量,计算出CMC的测量不确定度为 ±0.1 mM,表明实验的精密度很高。
- CMC与温度的关系(图2):
- 图2 绘制了 作为纵坐标,温度 作为横坐标的曲线。
- 关键特征:这条曲线不是单调变化的,而是呈现出一个 U形,在20-25°C附近有一个最小值。这意味着,从低温开始升温,CMC先是减小(更容易形成胶束 micelles),达到一个最小值后,再继续升温,CMC反而会增大(更难形成胶束 micelles)。
- 现象的普遍性:作者指出,这个U形曲线是SDS体系的典型特征,不仅通过电导法 conductometry,通过其他多种实验方法(如声学法、光谱法)也能观察到,证实了这一现象的客观存在。
- 数据拟合:
- 为了定量描述这个U形曲线并方便求导,作者使用了引言中提到的推荐公式对实验数据点进行拟合:
- 拟合参数:通过最小二乘法拟合,得到了最佳的参数值:,,。
- 拟合优度:拟合的相关系数平方 ,这个值非常接近1,表明该函数形式能够非常好地描述实验数据。
- 应用:有了这个精确的拟合方程,就可以通过解析求导来计算任意温度下的导数 ,这是计算焓 enthalpy变 所必需的。
- 为了定量描述这个U形曲线并方便求导,作者使用了引言中提到的推荐公式对实验数据点进行拟合:
在每个温度下, 通过方程12计算。在整个温度范围内,观察到 随温度呈线性依赖关系,斜率 slope为 (数据未显示)。此时,CMC、 及其温度依赖性可直接用于分别使用方程5和6计算 和 。在不同温度下获得的 、 和 结果列于表1中,并描绘在图3中。请注意, 的值与Benrraou等人¹³获得的值相同,也接近Aniansson等人¹⁹报道的值( )。 值略低于文献中发现的量热值 calorimetric values¹⁴˒²⁸。有趣的是, 在所有温度下保持负值且相对恒定,证实当浓度达到CMC值时,胶束 micelles形成是自发发生的。此外, 值的恒定性揭示了在所有温度下 和 之间的抵消效应。
20. 内容解释
这一段报告了 的计算结果以及最终的热力学 Thermodynamics参数计算结果,并对这些结果进行了初步分析。
- 的计算与趋势:
- 在每个实验温度下,利用之前测得的斜率 slope 和 ,以及从文献查得的 和 ,代入方程(12),解出胶束 micelles电离度 degree of ionization of the micelles 。
- 温度依赖性:将不同温度下的 值作图(文中说数据未显示),发现 随温度线性增加,斜率 slope为 0.0013 K⁻¹。这意味着温度越高,胶束 micelles表面的反离子 ion** counterion**解离得越多,胶束 micelles的有效电荷也越大。这个线性关系可以用来计算导数 。
- 热力学 Thermodynamics参数的计算:
- 现在,所有计算所需的要素都已备齐:CMC(T)、,以及它们的温度导数。
- 将这些值代入公式(4)、(5)、(6),就可以计算出在每个温度下的 、 和 。
- 结果展示与验证:
- 所有计算结果汇总在表1中,并绘制在图3中。
- 的验证:在25°C时计算出的值为 -21.2 kJ/mol。这个值与其他文献报道的值非常接近,验证了整个实验和计算方法的准确性。
- 的比较:作者坦诚,他们通过吉布斯-赫姆霍兹方程 Gibbs-Helmholtz equation(一种间接方法)计算出的焓 enthalpy变值,比用量热法(直接测量热量变化)得到的值要略低一些。这可能是由于模型简化或数据处理中的微小误差造成的。
- 对热力学 Thermodynamics结果的初步观察(图3):
- 自发性:在所有研究的温度范围内, 始终为负值,这表明胶束 micelles的形成是一个自发过程。
- 的恒定性: 的值随温度变化很小,几乎是一条平线。
- 焓 enthalpy熵 entropy补偿:由于 ,而 几乎不变,这必然意味着 和 这两项在很大程度上相互抵消了它们随温度的变化。从图3可以看出, 和 都随温度有显著的线性变化,但它们的差值却保持稳定。这种现象被称为焓 enthalpy-熵 entropy补偿效应 enthalpy-entropy compensation** (enthalpy-entropy compensation)**。
表1. 不同温度下SDS胶束 micelles化 micellization的CMC、 和热力学 Thermodynamics参数
| T/K | CMC/mM | ||||
|---|---|---|---|---|---|
| 284 | 8.4 | 0.19 | -20.4 | -0.6 | 70 |
| 288 | 8.2 | 0.20 | -20.7 | -2.1 | 65 |
| 293 | 8.0 | 0.21 | -21.1 | -4.1 | 58 |
| 298 | 8.2 | 0.22 | -21.2 | -6.2 | 50 |
| 303 | 8.2 | 0.22 | -21.6 | -8.3 | 44 |
| 308 | 8.4 | 0.23 | -21.7 | -10.3 | 37 |
| 313 | 8.7 | 0.24 | -21.8 | -12.5 | 30 |
| 323 | 9.2 | 0.25 | -22.1 | -16.7 | 17 |
| 333 | 9.2 | 0.26 | -22.3 | -21.0 | 4 |
21. 内容解释
这张表格是本文核心数据的汇总,直观地展示了实验测量值和最终计算出的热力学 Thermodynamics参数随温度的变化情况。
- 第一列 (T/K):实验进行的绝对温度,单位是开尔文(K)。
- 第二列 (CMC/mM):在对应温度下,通过电导法 conductometry测得的临界胶束 micelles浓度 Critical Micelle Concentration, CMC,单位是毫摩尔/升(mM)。我们可以看到,CMC值先减小后增大,在293 K到303 K之间达到最小值,这与图2的U形曲线一致。
- 第三列 ():在对应温度下,通过公式(12)计算出的胶束 micelles电离度 degree of ionization of the micelles。可以看到, 随温度的升高而单调增加,从0.19增加到0.26。
- 第四列 ():计算出的摩尔标准吉布斯自由能 molar standard Gibbs free energy变,单位是千焦/摩尔(kJ/mol)。这些值全部为负,且变化范围很小(从-20.4到-22.3),印证了胶束 micelles化 micellization是自发过程且 相对恒定。
- 第五列 ():计算出的摩尔标准焓 enthalpy molar standard enthalpy变,单位是千焦/摩尔(kJ/mol)。焓 enthalpy变随温度升高而变得越来越负(放热越来越多)。在低温区(284 K),焓 enthalpy变接近于零,甚至可能为正(吸热),而在高温区则变为显著的放热过程。
- 第六列 ():计算出的摩尔标准熵 entropy molar standard entropy变,单位是焦耳/(开尔文·摩尔)(J·K⁻¹·mol⁻¹)。熵 entropy变随温度升高而显著减小,从低温下较大的正值(70 J·K⁻¹·mol⁻¹)减小到高温下很小的正值(4 J·K⁻¹·mol⁻¹)。
表格总结:这张表格清晰地展示了SDS胶束 micelles化 micellization过程的热力学 Thermodynamics全貌。它不仅给出了最终的热力学 Thermodynamics函数值,还保留了中间的关键实验数据(CMC和),让读者可以清楚地看到从实验到结论的整个逻辑链条。这些数据是后续进行物理化学 Physical Chemistry讨论的基础。

图1. 在11°C (•)、15°C (◊)、20°C (△)、25°C (▲)、30°C (●)、35°C (○)、40°C (□)、50°C (■) 和60°C (×) 下记录的电导率 Conductivity ( ) 随SDS浓度的变化。
22. 内容解释
这张图是本文最原始的实验数据图,展示了电导法 conductometry测定CMC的原理和结果。
- 坐标轴:
- 横坐标 (SDS concentration / % w/v):SDS的浓度,单位是质量/体积百分比。
- 纵坐标 (Conductivity, / mS cm⁻¹):溶液的电导率 Conductivity,单位是毫西门子/厘米。
- 数据系列:图中的每条线(用不同符号表示)代表在一个特定温度下测得的一系列数据点。例如,黑三角(▲)代表25°C下的数据。
- 图像特征:
- 两段线性区:对于每条温度曲线,都可以清晰地看到它由两段近似直线的部分组成。
- 斜率 slope变化:在低浓度区,直线的斜率 slope较大;在高浓度区,直线的斜率 slope明显变小。
- 拐点 (Kink):两条直线的转折点非常明显。这个拐点在横坐标上对应的浓度值,就是该温度下的临界胶束 micelles浓度 Critical Micelle Concentration, CMC(CMC)。
- 物理意义:
- 斜率 slope**(低浓度区):反映了自由的SDS单体 monomer**( 和 离子 ion)对电导率 Conductivity的贡献。浓度每增加一个单位,就相应增加了一定数量的自由离子 ion,电导率 Conductivity因此快速上升。
- 斜率 slope**(高浓度区):反映了新加入的SDS形成胶束 micelles后对电导率 Conductivity的贡献。由于胶束 micelles体积大、移动慢,并且会束缚部分反离子 ion counterion**,导致电导率 Conductivity的增加速率远低于低浓度区。
- 温度效应:从图中可以看出,温度对电导率 Conductivity有显著影响。在相同浓度下,温度越高,离子 ion的运动速度越快,溶液的电导率 Conductivity也越高。因此,整个曲线族随着温度的升高而向上平移。
 图2. SDS的 随温度的变化。实线表示 形式的函数。误差棒是根据对同一组样品进行五次独立测量取平均值计算得出的。
图2. SDS的 随温度的变化。实线表示 形式的函数。误差棒是根据对同一组样品进行五次独立测量取平均值计算得出的。
23. 内容解释
这张图展示了从图1中提取出的CMC值是如何随温度变化的,是进行热力学 Thermodynamics分析的关键中间步骤。
- 坐标轴:
- 横坐标 (Temperature / K):绝对温度,单位是开尔文。
- 纵坐标 ():临界胶束 micelles浓度 Critical Micelle Concentration, CMC的自然对数。取对数是为了与热力学 Thermodynamics公式(如公式4)的形式保持一致,并且通常能使数据呈现出更好的规律性。
- 数据点与误差棒:
- 图中的每个点代表在一个特定温度下测得的 值。
- 每个点上的误差棒 (error bars) 显示了该测量值的不确定度范围,这是通过多次重复实验计算得到的,反映了实验结果的精密度。
- 曲线特征:
- 数据点清晰地呈现出一个 U形(或抛物线形) 的趋势,在约295 K(22°C)附近达到一个最小值。
- 拟合曲线(实线):
- 图中的实线是对这些实验数据点进行数学拟合后得到的曲线。
- 使用的拟合函数是 。
- 从图中可以看出,这条实线非常好地穿过了所有数据点的中心,表明该函数能够精确地描述CMC随温度变化的复杂行为。
- 图像的意义:
- 直观展示:直观地显示了SDS胶束 micelles化 micellization行为对温度的敏感性,并揭示了其非单调的变化规律。
- 定量分析的基础:这条拟合曲线的数学表达式是后续计算热力学 Thermodynamics参数(特别是焓 enthalpy变 )的直接依据,因为我们需要对它求导数 。
 图3. 热力学 Thermodynamics参数 、 和 随温度的变化。
图3. 热力学 Thermodynamics参数 、 和 随温度的变化。
24. 内容解释
这张图是本文最重要的结果图,它将最终计算出的三个核心热力学 Thermodynamics参数随温度的变化关系可视化地呈现出来。
- 坐标轴:
- 横坐标 (Temperature / K):绝对温度,单位是开尔文。
- 纵坐标 (Thermodynamic parameters / kJ mol⁻¹):热力学 Thermodynamics参数的值,单位是千焦/摩尔。
- 三条曲线:
- (吉布斯自由能变,通常用方块等符号表示):
- 这条线几乎是水平的,且全部位于零点以下(负值)。
- 物理意义: 表明SDS的胶束 micelles化 micellization在整个研究温度范围内都是一个自发过程。其值随温度变化很小,说明过程的自发性强度对温度不敏感。
- (焓 enthalpy变,通常用圆圈等符号表示):
- 这条线是一条斜率 slope很陡的直线,随温度升高而急剧下降。
- 物理意义:在低温区(< 285 K), 接近零或为正值,说明此时胶束 micelles化 micellization过程是吸热的或不放热。随着温度升高, 变为负值且越来越负,说明过程转变为放热的,并且放热效应越来越强。
- (熵 entropy变贡献项,通常用三角等符号表示):
- 这条线也是一条斜率 slope很陡的直线,同样随温度升高而急剧下降。
- 物理意义:由于 本身是正值(见表1),所以 代表了熵 entropy对吉布斯自由能的贡献()。在低温区, 是一个大的正值,是驱动反应自发进行的主要因素。随着温度升高, 逐渐减小,熵 entropy的驱动作用减弱。
- (吉布斯自由能变,通常用方块等符号表示):
- 焓 enthalpy**-熵 entropy补偿现象**: 这张图是焓 enthalpy**-熵 entropy补偿的经典展示。 和 两条线几乎是平行的,它们都随温度发生剧烈变化,但它们的差值** (即 )却几乎保持不变。这说明焓 enthalpy变和熵 entropy变的变化是协同的、相互补偿的。
8 讨论
从这些实验中获得的热力学 Thermodynamics信息可能有助于激发学生对原始数据进行批判性评估的兴趣。在这种背景下,实验室教师可能会提出几个相关问题:
- 为什么在室温下,尽管表面活性剂 surface active agent, surfactant在组织成胶束 micelles实体时采取了更有序的构型,但 仍然是正的?
- 为什么随着温度升高, 会下降?
- 胶束 micelles化 micellization过程是焓 enthalpy驱动过程 enthalpy-driven process还是熵 entropy驱动过程 entropy-driven process?
25. 内容解释
这部分是论文的讨论部分,旨在对实验结果进行深入的物理解释,并将其作为教学工具,引导学生进行思考。
- 教学目的:作者明确指出,本节的目的是利用实验获得的热力学 Thermodynamics数据,激发学生进行批判性思维。不仅仅是接受数据,而是要理解数据背后的物理化学 Physical Chemistry原理。
- 引导性问题:为了达到这个目的,作者(作为“实验室教师”的角色)提出了三个核心问题。这三个问题层层递进,直指胶束 micelles化 micellization热力学 Thermodynamics的本质。
- 问题一:熵 entropy增的悖论
- 表面现象:许多单个、自由运动的表面活性剂 surface active agent, surfactant分子聚集成一个结构规整的胶束 micelles,从表面活性剂 surface active agent, surfactant分子的角度看,这是一个从无序到有序的过程,熵 entropy应该是减少的()。
- 实验事实:然而,实验结果(表1)显示,在室温下 是一个大的正值。
- 核心矛盾:这个明显的矛盾需要一个更深层次的解释。
- 问题二:熵 entropy变随温度的变化
- 实验事实:表1显示, 随着温度的升高而减小。
- 需要解释:为什么熵 entropy增的效应会随着温度升高而减弱?
- 问题三:过程的驱动力
- 热力学 Thermodynamics驱动力:一个自发过程()可以由焓 enthalpy驱动(,放热)、熵 entropy驱动(,熵 entropy增),或两者共同驱动。
- 需要判断:根据图3和表1的数据,SDS的胶束 micelles化 micellization过程,其主要驱动力是什么?这个驱动力是否随温度而改变?
- 问题一:熵 entropy增的悖论
这些问题为接下来的段落设定了讨论的框架,使得解释更有针对性。
作为对这些问题的可能回答,可以考虑以下物理论点。与溶液中的单体 monomer状状态相比,聚集成胶束 micelles状态的表面活性剂 surface active agent, surfactant表现出更有序的结构。因此,人们可能会倾向于得出胶束 micelles化 micellization应该涉及系统熵 entropy减少的结论。然而,这种推理与实验证据不符,实验证据表明在低温下 为正。这种表面上的悖论可以通过考虑仅凭表面活性剂 surface active agent, surfactant的自由度 degrees of freedom不能提供完整图像,并且表面活性剂 surface active agent, surfactant结构的重组涉及伴随的溶剂结构变化来解释。事实上,围绕胶束 micelles的水分子与溶剂化单个SDS单体 monomer的水分子相比,其组织程度较低。这种效应会导致一个正的熵 entropy贡献,该贡献超过了由于SDS自由度 degrees of freedom损失而引起的熵 entropy减少。
26. 内容解释
这一段详细解答了第一个问题,即为什么胶束 micelles化 micellization过程的熵 entropy变是正的,引入了著名的疏水效应 hydrophobic effect** (hydrophobic effect)**。
- 分析系统总熵 entropy变:要理解总熵 entropy变 ,不能只看溶质(表面活性剂 surface active agent, surfactant),还必须考虑溶剂(水)的变化。总熵 entropy变是这两部分变化之和:
- 表面活性剂 surface active agent, surfactant的熵 entropy变 ():
- 当自由的、可以随意平动和转动的单个表面活性剂 surface active agent, surfactant分子被束缚进一个胶束 micelles结构中时,它们的运动自由度 degrees of freedom大大降低。
- 这是一个从无序到有序的过程。
- 因此,这部分的熵 entropy变是负的 ()。
- 水的熵 entropy变 ():
- 这是理解悖论的关键。当单个表面活性剂 surface active agent, surfactant分子的疏水尾部 hydrophobic tail(碳氢长链)分散在水中时,为了最大限度地维持水分子之间的氢键网络,水分子会在疏水尾部 hydrophobic tail周围形成一个高度有序的、类似“笼子”或“冰山”的结构。这种结构比普通液态水更有序。
- 当胶束 micelles形成时,所有疏水尾部 hydrophobic tail都聚集到了胶束 micelles内部,不再与水直接接触。
- 这导致原本束缚在疏水尾部 hydrophobic tail周围的那些高度有序的水分子被释放出来,回归到无序的、自由的本体水中。
- 这是一个从有序到无序的过程。
- 因此,这部分的熵 entropy变是大的正值 ()。
- 结论:
- 胶束 micelles化 micellization过程的总熵 entropy变是表面活性剂 surface active agent, surfactant熵 entropy减和水分子熵 entropy增共同作用的结果。
- 实验观察到 ,这表明水分子被释放所带来的巨大熵 entropy增,超过了表面活性剂 surface active agent, surfactant分子聚集所造成的熵 entropy减。
- 因此,胶束 micelles化 micellization的主要熵 entropy驱动力来自于溶剂(水),而不是溶质本身。这个现象就是“疏水效应 hydrophobic effect”的核心。
随着温度升高,表面活性剂 surface active agent, surfactant分子的溶剂化结构预计会逐渐减弱。Evans和Wightman¹⁸表明,对于十四烷基三甲基溴化铵,溶剂化效应在高于116°C的温度下变得可以忽略不计。因此,当温度升高时,由于水分子在胶束 micelles化 micellization过程中的贡献减少,预计 会下降。
27. 内容解释
这一段解答了第二个问题:为什么 会随着温度的升高而下降。
- 温度对水结构的影响:
- 在低温下,水分子之间的氢键网络比较强,疏水尾部 hydrophobic tail周围形成的“笼状”水结构也比较稳定和有序。
- 随着温度的升高,分子的热运动加剧,水分子自身的氢键网络已经被部分破坏,整体结构变得更加无序。
- 因此,在高温下,疏水尾部 hydrophobic tail周围的溶剂化水层本身就没有那么有序了。
- 对熵 entropy变的贡献:
- 低温时:胶束 micelles化 micellization过程释放的是高度有序的水分子,使其变为无序的本体水,熵 entropy的增加量()非常大。
- 高温时:胶束 micelles化 micellization过程释放的是本身就不太有序的水分子,使其变为无序的本体水,熵 entropy的增加量()就相对较小。
- 结论:
- 因为胶束 micelles化 micellization的总正熵 entropy变主要来自于水分子的贡献,而这个贡献随着温度的升高而减小,所以总的 就会随温度升高而下降。
- 作者还引用了一个极端例子:对于另一种表面活性剂 surface active agent, surfactant,当温度足够高(>116°C)时,水的溶剂化效应几乎消失,届时熵 entropy变可能就不再是主要驱动力了。
和 随温度显示出大的线性变化。然而,这些变化相互抵消,导致 的值在整个研究温度范围内几乎不变。这种现象在文献中被称为“补偿现象”。从这个热力学 Thermodynamics观点来看,SDS胶束 micelles化 micellization在低温下被认为是熵 entropy驱动过程 entropy-driven process,在高温下被认为是焓 enthalpy驱动过程 enthalpy-driven process。
28. 内容解释
这一段解答了第三个问题,即胶束 micelles化 micellization过程的驱动力是什么,并总结了焓 enthalpy-熵 entropy补偿现象。
- 回顾焓 enthalpy**-熵 entropy补偿**:
- 如图3所示, 和 (或 )都对温度非常敏感,呈线性变化。
- 但它们的变化方式恰好使得它们的组合 几乎不随温度变化。
- 过程驱动力的转变:
- 在低温区(例如 284 K):
- (接近于零,对自发性贡献很小)。
- (一个大的负值)。
- 此时, 的负值几乎完全由熵 entropy项 贡献。因此,在低温下,胶束 micelles化 micellization是一个典型的熵 entropy驱动过程 entropy-driven process** (entropy-driven process)。其根本原因是疏水效应 hydrophobic effect**。
- 在高温区(例如 333 K):
- (一个大的负值,强烈的放热)。
- (贡献已经变得很小)。
- 此时, 的负值主要来自于焓 enthalpy项 的贡献。因此,在高温下,过程转变为焓 enthalpy驱动过程 enthalpy-driven process** (enthalpy-driven process)**。
- 焓 enthalpy变为负的原因可能与胶束 micelles核心形成时,碳氢链之间的范德华吸引力有关。
- 在低温区(例如 284 K):
- 总结:SDS胶束 micelles化 micellization的驱动力不是一成不变的。它经历了一个从低温下的熵 entropy驱动到高温下的焓 enthalpy驱动的平滑过渡。这个有趣的转变是理解胶束 micelles化 micellization热力学 Thermodynamics全貌的关键。
9 结论
我们提出了一项新的实验室实验,通过胶束 micelles系统引入基本热力学 Thermodynamics概念。数据的合理化可以置于“闭合缔合模型 closed association model”的框架内,该模型建立了表面活性剂 surface active agent, surfactant单体 monomer和胶束 micelles状态之间的平衡 equilibrium。我们已经表明,在不同温度下进行的表面活性剂 surface active agent, surfactant溶液电导率 Conductivity测量是评估理论方法中两个关键要素——CMC和胶束 micelles电离度 degree of ionization of the micelles ——的便捷途径。该实验技术代表了一种无害、简单、稳健且可重现的实验室实验,可以在本科生实验室课程中进行。对描述胶束 micelles化 micellization过程的不同热力学 Thermodynamics量的温度趋势的简单考虑,可用于进行有趣的讨论,以合理化控制溶液中这种聚集过程的基本机制。
29. 内容解释
这是文章的结论部分,对全文的工作进行了总结和评价。
- 主要贡献:本文提供了一个全新的本科实验项目,该项目能够让学生通过研究胶束 micelles体系来学习和应用基本的热力学 Thermodynamics概念。
- 理论与实践的结合:
- 理论框架:实验数据的分析基于“闭合缔合模型 closed association model”,该模型描述了单体 monomer与胶束 micelles之间的平衡 equilibrium。
- 实验方法:采用简单的电导率 Conductivity测量法,在不同温度下方便地测定出模型所需的两个核心参数:CMC和 。
- 实验的优点:
- 无害 (harmless):实验过程安全风险低。
- 简单 (simple):操作和设备要求不高。
- 稳健 (robust):实验结果可靠,不易受微小扰动影响。
- 可重现 (reproducible):不同人或不同次重复实验能得到相似的结果。 这些优点使得该实验非常适合在教学实验室中推广。
- 教学价值:
- 本实验不仅仅是让学生练习操作和测量,更重要的是,通过分析最终得到的热力学 Thermodynamics参数()随温度的变化趋势,可以引导学生进行深入的物理化学 Physical Chemistry讨论。
- 学生可以从中理解到,像胶束 micelles化 micellization这样看似简单的自聚集过程,其背后受控于熵 entropy、焓 enthalpy以及溶剂效应等多种复杂而深刻的基本机制。这有助于培养学生的科学探究能力和批判性思维。